
Son una serie de patologías infecciosas, sin ser causadas por un microbio; pese a ser una patología degenerativa, tiene un progreso rápido y fulminante muy similar a una enfermedad bacteriana o viral; y también puede ser desencadenada por alteraciones genéticas.
¿Qué son los priones?
Los priones son proteínas con alteraciones en su estructura tridimensional, se encuentran mal plegadas, son capaces de producir una serie de enfermedades infecciosas en los mamíferos, y causan un grupo de patologías degenerativas de rápido y fatal desenlace.
En el organismo humano existe una proteína llamada Prion Protein Cellular Isoform (PrPC), que se encuentra en altas concentraciones en el Sistema Nervioso Central (SNC), aunque también está presente en menor proporción en células sanguíneas, hígado, corazón y pulmones.
La función de la PrPC está relacionada con el ritmo circadiano o reloj biológico del organismo, con el aprendizaje espacial, con la mielinización de los nervios periféricos, con la actividad antiapoptótica (disminuir la muerte celular programada) y además es un quelante del cobre.
¿Qué significa una proteína mal plegada?
Las proteínas son macromoléculas que se encargan de formar la estructura celular, están formadas por secuencias de aminoácidos (estructura primaria).
El plegamiento de estos aminoácidos le confiere su estructura secundaria que puede ser en hélice alfa o en hoja beta.
La disposición tridimensional de los átomos que componen la proteína le confiere la estructura terciaria, y esta disposición es la responsable de los efectos biológicos de la proteína, la estructura puede ser fibrosa (colágeno, queratina) o globular que tienen forma más o menos esférica (albúmina, globulina).
Cuando una proteína consta de más de una cadena polipeptídica, es decir cuando se trata de una proteína oligomérica, adquiere una estructura cuaternaria.
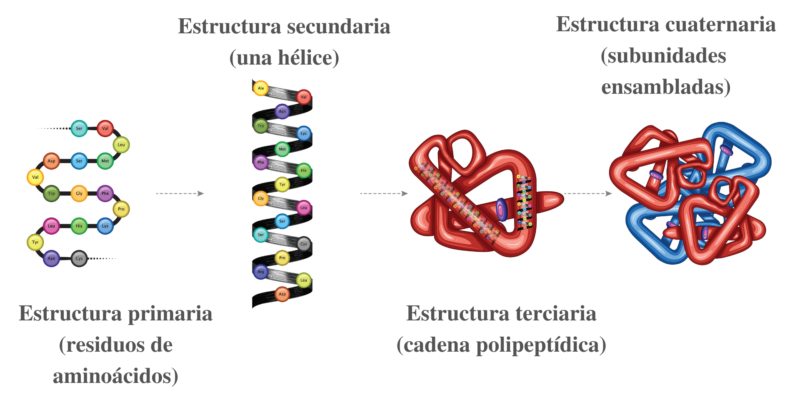
Imagen 1 Esquema representativo de la estructura primaria, secundaria, terciaria y cuaternaria de las proteínas.
Algunas variaciones genéticas predisponen a que la Prion Protein Cellular Isoform (PrPC) tenga errores en su estructura secundaria, terciaria o cuaternaria, y en ese caso, esta proteína con errores toma el nombre de Prion Protein Scrapie Isoform (PrPSc).
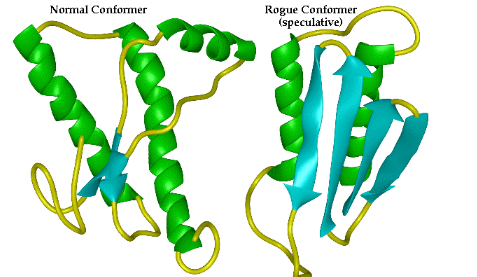
Imagen 2. Esquema comparativo de la estructura tridimensional de la Prion Protein Cellular Isoform (PrPc) a la izquierda y la Prion Protein Scrapie Isoform (PrPSc) derecha. Nótese que mientras que la estructura normal tiene menos del 5% de láminas beta, en la estructura anómala puede llegar hasta un 43% de láminas beta (azul claro). Esta estructura anómala le da características químicas y físicas diferentes, como por ejemplo ser resistente a enzimas pepsinas, ser insoluble y el hecho de ya no poder hacer parte de la membrana celular, sino, que se van almacenando en los espacios intra y extracelulares.
¿Qué produce en el organismo los priones?
Debido a que como se dijo anteriormente, es el sistema nervioso central el órgano con mayor concentración de PrPc, los síntomas se dan a este nivel. Produce una enfermedad llamada encefalopatía espongiforme, que se caracteriza por una demencia de rápida instauración, alteraciones en la marcha y alteraciones del movimiento.
La entidad clínica más conocida dentro de estas enfermedades es la enfermedad de las vacas locas (Creuzfeldt – Jakob), pero hay otras menos conocidas como el insomnio fatal y la enfermedad de Gerstman – Sträussler – Scheinker.
¿Cómo se contraen las enfermedades por priones?
La encefalopatía espongiforme es la característica común de las enfermedades por priones. Se caracteriza porque se forman vacuolas o lagos en el cerebro, se puede adquirir por exposición a priones infecciosos, por mutación genética del gen PRNP que codifica la Prion Protein Cellular Isoform (PrPC) o de forma esporádica sin que ninguna de las dos primeras tenga lugar.
Una vez se inicia el proceso de conversión de PrPC a PrPSc se desencadena una propagación autocatalitica que involucra el reclutamiento de nuevas PrPC para convertirlos en PrPSc mediante unión de Complejos PrPC – PrPSc.
Todavía no está del todo dilucidada la razón por la que los PrPSc inician y propagan un proceso de conversión de las PrPC a PrPSc.
Estos Complejos PrPC – PrPSc son muy resistentes a la degradación, y la acumulación de estas proteínas tanto a nivel intra como extracelular, desencadenan la muerte neuronal.
No hay vuelta atrás y esta enfermedad termina inexorablemente con la muerte del paciente, hasta la fecha no existe tratamiento para esta enfermedad, pero, en este momento se encuentra en fase preclínica una terapia génica con un inhibidor de RNAm del PrPC, con resultados prometedores.
Bibliografía
MallucciG, Dickinson A, Linehan J, Depleting neuronal PrP in prion infection prevents disease an reverses spongiosis. Science 2003
Rosenberg´s Moluclar and Gnetica Basis of Neurological and Psychiatric Disease 6 Ed. (2021) Ed AP








